膀胱癌免疫治療的強勁玩家,只知道K和O就out啦!
編輯:全球華人抗癌新藥網 來源:全球華人抗癌新藥網 發佈時間:2018-08-10
膀胱癌是全球發病率和死亡率最高的十大癌症之一。2017年統計資料顯示,美國總共有79030例新發的膀胱癌,而同一時期因膀胱癌死亡的病例高達16870例。其中,男性占新發病例(76.5%)和死亡病例(72.6%)的大多數。類似的情況也在歐洲發生,最新的流行病學統計資料顯示,歐洲的膀胱癌發病率為17.7/100,000(男性)和3.5/100,000(女性)。並且,70%的新發病例為大於65歲的中老年人。在中國,2015年預計新發膀胱癌例數80000餘例。
隨著平均年齡的增長和老齡化社會的加劇,膀胱癌的發病率將會節節攀升。
目前,早期的膀胱癌患者可以通過手術獲得治癒效果。但是,超過10%的膀胱癌患者在初次診斷時即為晚期。並且,有一半以上的患者在手術切除後出現局部復發或遠處轉移。對於這些晚期或者復發轉移的患者,姑息性全身治療是延長生存期、改善生活品質的首選方案。
在一線治療中,含鉑的聯合化療方案是治療的基石,經含鉑方案治療後,患者的總生存期(OS)可以達到9到15個月。然而,在含鉑方案治療復發後,即使經過後續化療,中位生存期也僅有5到7個月。因此,眾多的臨床醫生寄希望于新研發的藥物更好地改善晚期膀胱癌的生存。
PD-L1抑制劑和PD-1抑制劑的陸續出現改變了膀胱癌患者二線以上治療有效率低的局面。目前已有兩種PD-1抑制劑(Nivolumab和Pembrolizumab)和三種PD-L1抑制劑(Atezolizumab,Avelumab和Durvalumab)被美國FDA批准用於晚期膀胱癌(無需評估PD-L1表達水準)的治療。隨著更多更新的臨床試驗資料不斷出現,讓醫生和患者看到晚期膀胱癌多線治療新的曙光。
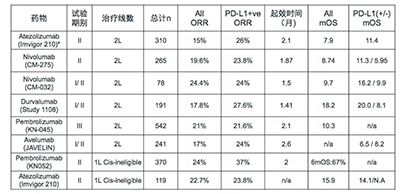
圖1 尿路上皮癌免疫治療臨床研究匯總-截止ASCO 2017年
目前,已有多項PD-1抑制劑和PD-L1抑制劑多線治療晚期膀胱癌的臨床試驗資料公佈,患者的生存改善時間被不斷刷新,效果好、毒性小的免疫靶向治療正在被越來越多的醫生認同。Pembrolizumab通過一項入組542例晚期膀胱癌患者的III期臨床試驗,證實其與化療相比,能更好地改善患者的生存(Pembrolizumab組比化療組:10.3個月比7.4個月),並且毒性更小。
而另一項基於Nivolumab的II期臨床研究發現,通過其治療後,患者的中位生存期達到了8.74個月,並且PD-L1表達超過1%的患者預後更好,能達到11.3個月。
此外,Atezolizumab也進行了一項入組了310例晚期膀胱癌患者的II期臨床試驗,試驗結果顯示通過其治療,患者的客觀緩解率首次達到15%,而歷史上化療的最佳客觀緩解率也僅有10%,並且對這些獲得緩解的患者進行11.7個月的隨訪後發現,大部分患者(84%)得到了腫瘤的長期長達控制。同樣,Avelumab的Ib期臨床試驗也獲得很好的生存資料,治療後的中位生存期達到了13.7個月,其中有54.3%的患者存活超過1年。

圖2 Durvalumab (imfinzi)產品圖
Durvalumab (imfinzi)(圖2)是PD-1及PD-L1家族中的後起之秀,其臨床試驗的結果一經公佈,就引起了廣大醫生和患者的普遍關注。最新的資料更新也於2017年8月於腫瘤學界的權威雜誌—JAMA oncology 上發表。該項研究是一項序貫I/II期臨床試驗,入組人群也為經一線或多線鉑類藥物聯合化療失敗後的191例晚期膀胱癌患者。通過每2週一次10mg/Kg Durvalumab靜脈注射的持續治療,最終客觀緩解率達到了17.8%,共有34例患者得到了部分緩解以上的療效,其中有7例達到了完全緩解。並且,腫瘤的縮小在治療早期就可以出現,中位的反應時間為1.41個月。從生存資料來看,經過Durvalumab治療的平均總生存期達到18.2個月,其中有55%的患者生存期超過1年。
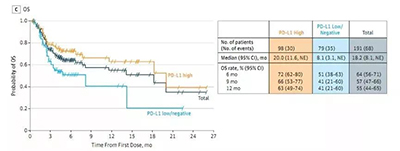
圖3 PD-L1高表達組和弱表達/不表達組的療效差異
在PD-L1表達差異和治療療效的相關性上,Durvalumab也體現出其卓越的治療能力。該試驗通過VENTANA PD-L1 (SP263) 檢測將人群分為PD-L1高表達組(98例)和弱表達/不表達組(79例),兩者在治療效果上的差異顯著(圖3)。PD-L1高表達組的總生存時間達到了20.0個月,而弱表達/不表達組也達到了8.1個月,兩者之間的客觀緩解率也存在27.6%對5.1%的差異。因此,通過簡單的檢測,就可以很好的篩選出Durvalumab的優勢人群,更好地為患者帶來獲益。
從安全性上來看,Durvalumab秉承了免疫靶向治療低毒性的一貫表現。雖然有60.8%的患者在治療後出現不良事件,但主要的反應僅為輕微的乏力、皮疹、食欲下降、肝功能受損以及腹瀉。而3級到4級的治療相關不良事件僅為6.8%,主要為乏力和肝功能受損,經停藥和對症治療後患者都得到了緩解。整個試驗中並未出現嚴重的間質性肺炎、自身免疫性肝炎等嚴重不良事件。

圖4 2018年新版NCCN推薦Durvalumab治療經鉑類藥物治療失敗後的晚期膀胱癌
由於Durvalumab在該臨床試驗的優秀表現,2017年5月1日,美國FDA加速批准了Durvalumab上市,用於治療晚期膀胱癌,成為第五個被FDA批准上市該類的產品。在更新後的NCCN膀胱癌指南2018年第1版中,也推薦Durvalumab作為經鉑類藥物治療失敗後的可選治療方案(圖4)。隨著進一步III期臨床試驗的開展,相信後續的有效性和安全性資料會進一步提升Durvalumab在晚期膀胱癌中的治療低位,為更多患者帶來福音。
