罕見淋巴瘤新藥獲美國FDA突破性療法認定
編輯:全球華人抗癌新藥網 來源:全球華人抗癌新藥網 發佈時間:2017-12-01
近日,Kyowa Hakko Kirin公司宣佈美國FDA已經接受mogamulizumab的生物製劑許可申請(BLA),用於治療曾接受過至少一種系統治療的皮膚T細胞淋巴瘤(CTCL)患者,並授予其優先審評資格。
皮膚T細胞淋巴瘤(CTCL)主要包括蕈樣肉芽腫(MF)和Sezary綜合征(SS)等。是一種罕見的非霍奇金T細胞淋巴瘤。這類疾病大多惡性程度較低,病情進展緩慢。但晚期由於全身免疫系統異常,繼發感染及罹患第2種腫瘤的概率明顯增加。本病目前尚無法根治,治療的主要目標在於維持長期緩解。
mogamulizumab是一款針對CC趨化因數受體4(CCR4)的人源化單克隆抗體(mAb),CCR4經常在某些惡性血液腫瘤(包括CTCL)的白血病細胞上表達。Mogamulizumab於2012年在日本首次被批准用於治療其它惡性血液腫瘤,並於2014年被批准用於治療CTCL。美國FDA已經授予mogamulizumab突破性療法認定,用於治療至少接受過一種系統治療的MF和SS患者。此次mogamulizumab再次獲得優先審評資格,證明它在治療CTCL方面的潛力。
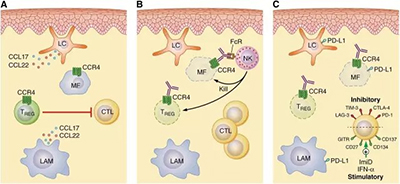
CCR4是皮膚T細胞淋巴瘤的治療靶點
此次獲得突破性療法的認定是基於一項Ⅲ期臨床試驗,名為MAVORIC。這項試驗為開放標籤、多中心、隨機試驗評估了mogamulizumab在使用過至少一種系統治療後失敗的MF和SS患者中的療效,它在美國、歐洲、日本和澳大利亞共招募了372名患者。頂線結果證明,使用mogamulizumab治療的患者的無進展生存期(PFS)相比對照組有顯著改善,同時耐受性良好。
Kyowa Hakko Kirin研發部副總裁兼執行官Mitsuo Satoh博士說到:“獲得突破性療法是一個重大成就,我們將繼續與FDA等監管機構合作,儘快向CTCL患者提供該藥物。”
希望更多藥物能為罕見的疾病提供治療的希望和可能,我們將持續關注。
