礼来新药Verzenio获FDA批准上市
编辑:全球华人抗癌新药网 来源:香港特区肿瘤中心 发布时间:2017-10-11
在九月的最后一天,礼来(Eli Lilly)公司传来喜讯,美国FDA批准了新药Verzenio(abemaciclib)上市,与fulvestrant联用治疗HR阳性、HER2阴性的晚期或转移性乳腺癌成人患者。此类患者都接受过内分泌疗法,但病情依旧出现了进展。同时,FDA也批准了Verzenio单独使用,用于治疗曾接受过内分泌疗法、化疗但又出现转移的患者群体。
全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势。美国8名妇女一生中就会有1人患乳腺癌。中国不是乳腺癌的高发国家,但不容乐观,近年我国乳腺癌发病率的增长速度却高出高发国家1~2个百分点。据国家癌症中心和卫生部疾病预防控制局2012年公布的2009年乳腺癌发病数据显示:全国肿瘤登记地区乳腺癌发病率位居女性恶性肿瘤的第1位,女性乳腺癌发病率(粗率)全国合计为42.55/10万,城市为51.91/10万,农村为23.12/10万,其中HR阳性、HER2阴性的患者占据了大多数,此次新药的上市,为乳腺癌的治疗格局带来了很大改观。
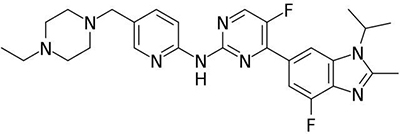
Abemaciclib的分子结构式
Verzenio是一款CDK4/6抑制剂,在细胞中,CDK4/6能促进肿瘤的生长。因此,通过抑制CDK4/6,Verzenio有望能控制乳腺癌的进展,改善病情。先前,这款新药曾获美国FDA颁发的突破性疗法认定与优先审评资格。
Abemaciclib的作用机理
在临床试验中,纳入669名患者,均为HR阳性、HER2阴性的乳腺癌,且全部接受过内分泌治疗,疾病出现了进展。试验结果显示,接受Verzenio与fulvestrant联合治疗的患者,中位无进展生存期(PFS)为16.4个月,高于使用安慰剂与fulvestrant联合的患者。(9.3个月)
Verzenio作为单独疗法的试验中,纳入了132名HR阳性、HER2阴性的乳腺癌患者,同样接受过内分泌或化疗,且疾病有了进展。在使用Verzenio单独治疗后,有19.7%的患者出现了完全缓解和部分缓解,中位客观缓解时间为8.6个月。
Verzenio无论是联合疗法还是单独使用,其安全性和有效性都获得了认可,这也是美国FDA批准的第三款CDK4/6抑制剂,也是单独一款可以单独使用的CDK4/6抑制剂。
“Verzenio为特定的乳腺癌患者带来了全新的靶向治疗方案。这些患者对目前的治疗没有响应。与该类别的其他新药不同,这款新药能作为单独疗法,治疗这些接受过内分泌疗法和化疗的患者。”美国FDA肿瘤学卓越中心主任兼FDA药物评估与研究中心血液学和肿瘤学产品办公室主任Richard Pazdur博士评论道。

我们祝贺礼来新药的上市,也同时欣喜于又有新的患者可以从中获益。
