美国FDA认定抗癌新药DS-8201为突破性疗法
编辑:全球华人抗癌新药网 来源:新浪医药 发布时间:2017-09-07
近日,美国FDA正式授予日本Daiichi Sankyo公司抗癌新药DS-8201突破性疗法认定,用于治疗既往接受帕妥珠单抗、曲妥单抗以及经ado-trastuzumab emtansine(T-DM1)治疗后出现病情恶化的HER2阳性,局部晚期或转移性乳腺癌患者。一般获得突破性疗法认定的药物,FDA会给与优待,在后续审批和上市过程中,开放绿色通道。
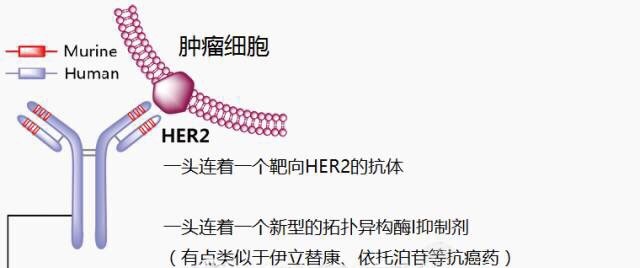
乳腺癌是全球女性发病率最高的癌症,约有五分之一的乳腺癌患者会表达HER2,这是一种在癌细胞表面发现的酪氨酸激酶受体生长促进蛋白,与侵袭性疾病相关。截至目前为止,尚未有任何一款药物获批用于经HER2靶点治疗药物(曲妥单抗、帕妥珠单抗以及T-DM1)治疗无效的HER2阳性转移性乳腺癌,这一领域还有巨大的医疗需求未被满足,此次突破疗法的授予,将极大推动DS-8201上市的审批进程。
DS-8201是又一个抗体耦联药物(ADC),ADC药物是采用特定的连接子将抗体和小分子细胞毒药物连接起来,其主要组成成分包括抗体、连接子和小分子细胞毒药物(smallmolecular cytotoxic drug,SM)。抗体分子主要发挥靶向投递作用,小分子药物发挥效应,也就是说,依靠抗体把化疗药精准的带到癌细胞身边,然后毒死他。这类药物疗效更加直接有效,副作用更小,是近几年抗癌药研发领域的新星。
HER2阳性的乳腺癌目前为止已经有不少靶向药:赫赛汀、帕妥珠单抗、T-DM1、拉帕提尼、来那替尼等,此类患者属于不幸中的万幸。但依然有一部分病人,对上述药物全部耐药,并且人数不在少数。此外,HER2阳性的癌症还见于肺癌、肠癌、胆管癌、胃癌等多种肿瘤,因此新药的开发迫在眉睫。
在纳入22例患者(16例乳腺癌,5例胃癌,1例胃食管结合部腺癌)的剂量递增试验中显示,每3周给予1次DS-8201a(0.8-8.0 mg/kg),最大耐受剂量仍未达到,也没有体现出剂量限制性毒性。最常见的不良反应主要为轻到中度的胃肠道和血液反应。3例患者报告了7件3级不良反应事件,包括低钾血,贫血,中性粒细胞计数降低,淋巴细胞计数降低,ALP增加和胆管炎。
20例可评价患者的初步疗效分析数据显示,DS-8201a实现了35%的客观应答率(7例部分缓解)。疾病控制率达到90%,包括12例既往接受过ado-trastuzumab emtansine (T-DM1)治疗和5例HER2低表达者(IHC2+/FISH- or IHC1+)的患者。在15例HER2+患者(IHC3+ or IHC2+/FISH+)中,疾病控制率更达到了100%。目前有17名患者仍在接受DS-8201a治疗,有5例患者接受治疗的时间超过了24周,中位无进展生存期尚未到达。
目前,DS-8201用于难治性HER2阳性的乳腺癌,二期临床试验已经启动,让我们翘首期盼。
